酶聯免疫吸附實驗(ELISA)是目前免疫實驗較為靈敏、可重復的技術之一。它快速、簡單易于自動化。與其它實驗一樣,ELISA實驗可重復性和可靠性取決于適當的技術和細節的關注。
ELISA常見的技術類型
ELISA常見的技術類型分為直接ELISA、間接ELISA和夾心ELISA。
-
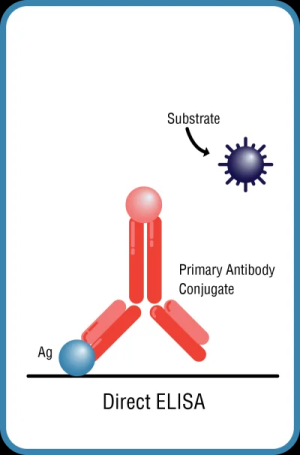
直接ELISA,其中抗原固定在ELISA板上,并且一抗帶有標記(圖1A)
-
-
-
-
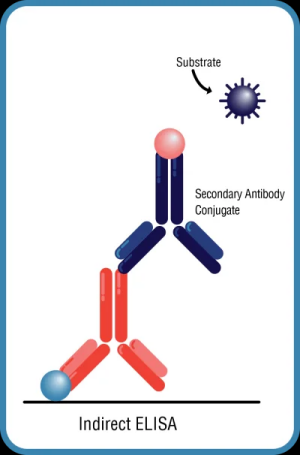
間接ELISA,其中抗原固定在ELISA板上,二抗帶有標記(圖1B)
-
-
-
-
-
夾心ELISA,其中兩種一抗(用于捕獲和檢測)嵌入抗原,形成“夾心”,然后復合物被二抗識別(圖1C)。
-
-

-
ELISA試劑盒中匹配的抗體對
配對抗體是指已知可識別同一蛋白質抗原上的不同表位的抗體組,因此它們可以一起用于在夾心ELISA中捕獲和檢測單一抗原。ELISA檢測中使用的抗體可以是單克隆抗體、多克隆抗體或兩者的組合。
單克隆抗體可用于所有類型的ELISA中所有含抗體的步驟。它們通常以匹配對的形式成套用于夾心ELISA,但可以與多克隆抗體一起用于捕獲或檢測,以增強信號或提供更大的機會從復雜溶液中捕獲抗原。
由于多克隆抗體溶液中存在的抗體異質性以及表位的廣泛代表性,多克隆抗體可以成為檢測抗原的有力工具,通常比單克隆抗體產生更高的信號水平。然而,多克隆抗體更有可能與密切相關的蛋白質共享一個或多個表位,從而產生更高的非特異性信號。減少此問題的一種方法是使用親和力純化或交叉吸收的多克隆抗體。為了提高檢測靈敏度,ELISA的檢測方法可以從直接檢測轉換為使用多克隆抗體的間接檢測。相關閱讀:《
單克隆 vs 多克隆抗體:科研實驗中的抉擇》
ELISA樣本
ELISA可以檢測多種樣本,檢測條件的選擇取決于樣本的復雜性和預期存在的抗原量。
重要的是,要結合已知標準對所有樣本進行兩次或三次測試,以確保結果和定量的準確性。最好對樣本進行多次稀釋測試,以確保最終結果在標準曲線的線性部分內。高濃度樣本可能會低估濃度,而高度稀釋的樣本可能會高估濃度。
ELISA封閉和清洗步驟
封閉通常是必要的,以防止檢測抗體與多孔板表面本身的非特異性結合。當板完全封閉時,檢測靈敏度將增強,因為非特異性信號將減少。
徹底清洗程序對于獲得可靠的ELISA結果至關重要。重要的是,通過輕輕將吸液頭放入底部,將所有孔中的液體完全吸出。避免刮傷孔內。清洗完成后,建議將板倒置并用吸水紙擦干。
如何優化您的ELISA實驗
ELISA實驗準確性有助于實驗結果的可靠性,下面結合日常ELISA實驗操作來優化幾點建議:
1)捕獲抗體濃度
在包被緩沖液中制備不同濃度的捕獲抗體。
2)阻斷緩沖液
準備不同的封閉液。如果封閉液不是預先配制的(即它是單一蛋白質,例如BSA),請嘗試不同濃度的蛋白質。
3)標準稀釋劑
嘗試使標準稀釋劑與樣品基質盡可能接近匹配。
如果基質本身無法精確復制,則測試不同的標準稀釋液,并檢查樣品的標準曲線和稀釋線性。可能需要選擇不同的稀釋劑。
如果樣品的線性較差,則樣品基質和標準稀釋劑之間可能存在不平衡。在這種情況下,應進行加標回收或稀釋線性實驗。
4)樣品濃縮
制備不同濃度的樣品,注意底物的檢測限。為了確認生物樣品基質不會掩蓋或增強信號,應進行加標回收和稀釋線性實驗。
5)檢測抗體濃度
制備不同濃度的檢測抗體。
6)酶結合物濃度
根據
ELISA試劑盒中針對底物描述的范圍,制備不同濃度的酶結合物。
7)信號檢測
根據樣品中的抗原量以及用平板讀取器檢測的能力來選擇底物。
如果可以清楚地檢測到抗原則表明底物是合適的。
如果抗原低于檢測閾值,則選擇更敏感的底物。
常見的ELISA問題
下面
上海通蔚為大家匯總了常見ELISA問題,了解這些問題有助于后期在實驗中減少出錯的概率。
1)ELISA檢測信號弱或無信號
建議在開始檢測前將所有試劑放置于室溫下15-20分鐘。
組件儲存不正確。仔細檢查試劑盒標簽上的儲存條件。大多數試劑盒需要儲存在2–8oC的環境中。
試劑添加/制備不正確。檢查方案,確保試劑以正確的順序添加,并準備正確的稀釋度。
熒光試劑過度曝光。強光會分解熒光團,導致光漂白。保護熒光團免受光照對于在檢測結束時有效產生信號至關重要。
組分需要進一步優化。檢測的某一組分可能處于限制濃度,導致整體信號較低。
試劑降解。其中一種試劑可能已降解或被污染,這種情況下應予以更換。
抗體配對效率低或對靶標缺乏足夠的親和力。所用的抗體可能無法有效地與抗原結合,或可能無法相互結合發揮作用。在這種情況下,必須測試替代抗體。
檢測系統需要進一步優化。檢測系統(底物)可能不夠靈敏,無法發出信號,或者標準曲線可能不適合該樣品。可能需要濃縮樣品或切換到更靈敏的底物。
2)背景高
清洗或封閉不充分。高背景信號通常是由于清洗或封閉不充分、樣品成分或抗體與封閉緩沖液發生交叉反應,或者使用了過多的酶結合物造成的。
平衡產生特定信號的酶量與產生背景信號的酶量非常重要。控制這一點的最有效方法是優化酶結合物、抗體和封閉液。
3)標準曲線線性差
如果標準曲線的線性較差,則樣品必須在嚴格的濃度范圍內才被視為準確的。
如果曲線具有良好的線性,但重復之間的變化較差(即標準誤差),則可能存在技術問題,例如樣品或個人用戶之間的移液不一致。
為了緩解此問題,應至少對所有樣品和標準進行兩次或三次測量。
4)ELISA信號過高
清洗不充分。為了避免此問題,請使用適當的清洗程序,例如,在每個清洗步驟結束時,將板倒置在吸水紙上并使其完全排干,必要時用力拍打以去除任何殘留液體。
孵育時間過長。孵育時間過長也是ELISA信號過高的原因之一;務必遵循建議的孵育時間。
污染。使用板密封劑可避免此問題,每次打開板時都使用新的密封劑。這將防止孔相互污染。


