發(fā)布時間:2024-09-29 發(fā)布作者:上海通蔚生物
Pcr(聚合酶鏈式反應)用于擴增DNA特定片段的聚合酶鏈式反應技術。在生命科學各個領域(基礎研究、生物技術、醫(yī)學、法醫(yī)學、診斷學等)都在廣泛應用這些方法。常規(guī)的PCR主要是定性檢測,而實時PCR(QPCR)可以用來定量檢測。今天,本文為大家詳細介紹下QPCR原理及步驟,為您的實驗選擇該技術有廣泛的了解。
目錄:
2、QPCR工作原理
3、QPCR步驟
4、QPCR應用
5、QPCR常見問題
定量聚合酶鏈式反應(QPCR)與PCR非常相似,在傳統(tǒng)PCR中,擴增的DNA產物或擴增子在終點分析中檢測。在QPCR中,隨著反應的進行,實時測量擴增產物的積累,并在每次循環(huán)后對產物進行量化。
為了理解QPCR的工作原理,我們使用典型的擴增圖來說明qPCR分析(圖1)。在該圖中,x軸顯示PCR循環(huán)數,y軸顯示擴增反應產生的熒光,該熒光與試管中擴增產物的量成正比。
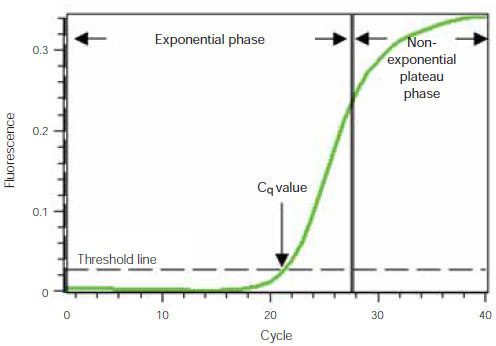
圖 1. 擴增圖(基線減去熒光與 PCR 循環(huán)數的關系)
擴增曲線顯示兩個階段,一個指數階段,接著是一個非指數平臺期。在指數階段,PCR產物的量在每個循環(huán)中大約增加一倍。然而,隨著反應的進行,反應組分被消耗,最終一種或多種組分變得有限。此時,反應減慢并進入平臺期(圖1中的循環(huán)28-40)。
最初,熒光仍處于背景水平,即使產物呈指數級積累,熒光的增加也是不可檢測的(循環(huán)1-18,圖1)。最終,足夠的擴增產物積累以產生可檢測的熒光信號。發(fā)生這種情況的循環(huán)數稱為定量循環(huán)或C q。由于C q值是在試劑不受限制的指數期測量的,因此可以使用實時qPCR根據描述反應進程的已知指數函數可靠而準確地計算反應中存在的模板的初始量。
反應的C q主要取決于擴增反應開始時模板的量。如果反應開始時模板量較大,則需要相對較少的擴增循環(huán)即可積累足夠的產物,從而產生高于背景的熒光信號。因此,反應的C q會較低或較早。相反,如果反應開始時模板量較小,則需要更多擴增循環(huán)才能使熒光信號高于背景。因此,反應的C q會較高或較晚。這種關系構成了QPCR定量方面的基礎。
樣本采集
為了分離RNA并量化基因表達,樣本材料應盡可能均勻。如果您的組織樣本由多種不同類型的細胞組成,則可能難以確定目標基因的表達模式。如果您的樣本不均勻,請使用多種可用于分離和隔離特定細胞類型的方法之一,例如組織解剖、針吸活檢和激光捕獲顯微解剖。然后可以使用收集的細胞來獲取RNA樣本。
RNA提取
總RNA或poly(A+)RNA可用于大多數實時RT-qPCR應用。使用RNA時,一個關鍵考慮因素是消除溶液、耗材和實驗室器具中的RNase。您可以購買即用型無RNase溶液,或者用焦碳酸二乙酯(DEPC)處理您的溶液,然后進行高壓滅菌。實驗室器具上的RNase也可以通過DEPC處理或在250°C下烘烤3小時來滅活。
制備好的RNA樣本可能需要DNase處理,以防止任何污染基因組DNA的潛在擴增,這可能導致對mRNA拷貝數的估計過高。然而,當起始材料有限時,DNase處理可能不合適,因為額外的操作可能會導致RNA丟失。可以通過設計轉錄本特異性引物(例如,跨越或擴增剪接點的引物)來阻止?jié)撛谖廴净蚪MDNA的擴增。
分析核酸數量和質量
準確的核酸定量對于基因表達分析至關重要,尤其是當使用總RNA量來標準化目標基因表達時。RNA濃度和純度通常通過測量260nm和280nm處的紫外吸光度比率來確定。
首先,使用PCR試劑和獨特或定制引物設置擴增反應。然后在QPCR儀器中運行反應,并使用專有儀器軟件分析收集的數據。
通過在每個反應孔中加入熒光報告分子,隨著產物DNA數量的增加,熒光也會增加,從而實現PCR產物的實時檢測。為此使用的熒光化學物質包括DNA結合染料和熒光標記的序列特異性引物或探針。配備熒光檢測模塊的專用熱循環(huán)儀用于在擴增發(fā)生時監(jiān)測熒光信號。測得的熒光與擴增子的總量成正比;熒光隨時間的變化用于計算每個循環(huán)中產生的擴增子的數量。
QPCR相對于PCR的主要優(yōu)勢在于,QPCR可讓您在寬動態(tài)范圍內準確且高靈敏度地確定模板DNA(擴增目標序列)的初始拷貝數。QPCR結果可以是定性的(序列的存在與否),也可以是定量的(拷貝數)。因此,定量QPCR也稱為qPCR分析。相比之下,PCR充其量是半定量的。此外,無需凝膠電泳即可評估實時qPCR數據,從而縮短了工作時間并提高了通量。最后,由于實時qPCR反應是在統(tǒng)一的閉管qPCR系統(tǒng)中運行和評估數據的,因此減少了污染的機會,并且在qPCR分析中無需進行擴增后操作。
qPCR用于檢測和量化給定樣本中的核酸。由于其靈敏度高,分子生物學家最常使用qPCR來測量 基因表達 ,以更好地了解各種疾病和其他生物途徑。使用qPCR開發(fā)的其他應用包括 下一代測序文庫量化、 病原體檢測、SNP檢測以及microRNA檢測和分析。
帶有接頭序列的序列在擴增過程中充當模板。使用qPCR的好處是所用材料量最少,并且能夠實現自動化。這兩種特性都允許執(zhí)行更多高通量運行。
溫馨提示,qPCR運行產生的數據很大程度上取決于您使用的染料和引物。如果您使用熒光DNA探針代替染料,您將能夠使用多重qPCR測量多個DNA目標。
什么是多重qPCR
多重qPCR允許在單個反應中同時檢測多個目標DNA(例如來自不同生物體)。我們所有的qPCR檢測都包括內部控制引物和探針組,雙鏈體也是如此。其他檢測,例如貓呼吸道綜合征qPCR檢測,可檢測兩個或更多個目標DNA以及內部控制。
qPCR檢測的敏感性和特異性如何?
qPCR靈敏度極高,特異性強,能夠檢測出樣本中數量極少的病原體。qPCR的靈敏度使得我們能夠通過對混合血清樣本或散裝牛奶樣本進行單次測試來篩查牛群中的BVDV。
哪些類型的樣本適合通過qPCR進行檢測?
qPCR是一種非常通用的技術,可以應用于多種樣本類型中DNA或RNA的定量分析。
什么是內部(擴增)控制?
內部(擴增)對照(IC)是與病原體核酸同時擴增的目標DNA或RNA。IC可以是宿主基因,也可以是在DNA提取階段添加到每個樣本中的人工DNA/RNA分子。它表明反應中存在可擴增的DNA。在qPCR反應中加入IC有助于識別與特定樣本、樣本收集、提交或實驗室處理相關的假陰性結果。
什么是閾值循環(huán)(ct)值?
閾值循環(huán)(ct)值是PCR產物量(通過熒光測量)達到規(guī)定閾值所需的PCR循環(huán)數。因此,ct值可以衡量樣本中存在的目標DNA量;因此,如果存在的目標DNA量高,則更快達到閾值,從而導致較低的ct值。通常,結果中不包括ct值。
上文為大家介紹QPCR及步驟,與“傳統(tǒng)”或終點PCR檢測相比,qPCR(也稱為實時PCR)不僅可以提供樣本中基因序列的存在與否,還可以提供定量數據——它是高靈敏度、特異性檢測和定量分子標記的黃金標準。本文篇幅有限,如果還有關于QPCR問題,歡迎前來咨詢!